Гаплогруппа L обнаружена у знатного гуннского воина в Венгрии
Гаплогруппа L обнаружена у знатного гуннского воина в Венгрии:
Л. Б. Джансугурова 1, К. Б. Джантаева 1, Нуржибек 1, Г. С. Жунусова 1, Е. Б. Кузовлева 1, Л. З. Мусралина 1, Ш. Эвингер 2, А. Кустар 2, О. А. Иксан 1, Э. М. Хусаинова 1
1 — Лаборатория популяционной генетики, РГП «Институт общей генетики и цитологии» КН МОН РК, Алматы, Казахстан,
2 — Департамент антропологии, Венгерский музей естественной истории, Будапешт, Венгрия
Аннотация.
Проведен палеогенетический анализ человеческих останков гуннского периода. Показано, что костные останки гуннского периода из Венгрии 100% характеризуются по L гаплотипу Y-хромосомы и D4j12 гаплотипу мтДНК, что является свидетельством азиатского происхождения отцовской и материнской линии древней находки из Европы.
Ключевые слова: палеогенетика, древняя ДНК, этногенетические реконструкции, популяционная генетика, гаплотип.
В настоящее время популяционная генетика нуждается в таком же систематическом изучении генофонда древнего населения, как и населения современного, причем исследование древнего генофонда требует с самого начала комплексного подхода со стороны генетики, археологии и палеоантропологии. Стремительное развитие технологий и методов молекулярной биологии позволило обратиться к новому объекту исследования — древней ДНК (палео-ДНК). Возможность применения в комплексных междисциплинарных исследованиях методов анализа древней ДНК из музейного, коллекционного материала и археологических находок является актуальной для широкого круга специалистов разных областей науки и значительно дополняет традиционные анализы антропологического материала [1]. Однако древняя ДНК находится в палеоматериале в следовых количествах, что обуславливает одну из важнейших проблем при ее исследовании — // Л. Б. Джансугурова, К. Б. Джантаева, Нуржибек, Г. С. Жунусова, Е. Б. Кузовлева, Л. З. Мусралина, Ш. Эвингер, А. Кустар, О. А. Иксан, Э. М. Хусаинова «Выделение и анализ древней ДНК из костных человеческих останков гуннского периода». / Известия национальной Академии Наук Республики Казахстан Института биологии и биотехнологии растений. Серия биологическая и медицинская. 4 (322). Июль—Август, 2017 г. Гл. ред. академик НАН РК, д. м. н., проф. Ж. А. Арзыкулов. Адрес типографии: ИП «Аруна», г. Алматы, ул. Муратбаева, 75. Алматы, НАН РК, 2017. С. 39
проблему аутентичности получаемых результатов. В лаборатории популяционной генетики Института общей генетики и цитологии ведется работа по апробации на реальных образцах методик выделения и амплификации аутентичных препаратов древней ДНК, и непосредственное применение методов исследования древней ДНК человека и животных для решения конкретных научных задач в рамках комплексных междисциплинарных исследований.
Целью данной работы является молекулярно-генетический анализ костных человеческих останков гуннского периода из коллекции Департамента антропологии Венгерского музея естественной истории (г. Будапешт, Венгрия).
Палеоантропологический контекст. В коллекции Департамента антропологии Венгерского музея естественной истории имеется более 1000 скелетов гуннского периода. Основываясь на историко-археологических данных (описание захоронения, одежды, оружия и сопутствующих предметов), данных антропологического исследования, а, главное, сохранности костных останков и отсутствии агрессивной химической обработки материала, для палеогенетического исследования нами был выбран объект с инвентарным номером 12763. Данная находка была обнаружена в 1961 г. во время реконструкционных работ в г. Будапешт и датируется средней третью V века н. э. (конец гунского периода в Карпатском бассейне).
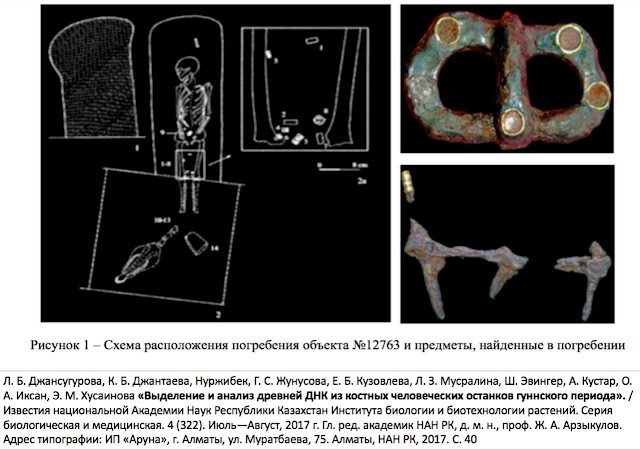
В могиле был скелет молодого человека, череп лошади, фрагменты конского убранства и дорогой одежды, инкрустированные золотыми бляшками и гранатами (рисунок 1).
Рисунок 1 — Схема расположения погребения объекта № 12763 и предметы, найденные в погребении
Стиль погребения c дорогим инвентарем указывает на тесную связь с сарматско-гуннскими погребениями, обнаруженными в Понтийской степи, в Крыму, на Кубани и Северном Каспии. Череп лошади был размещен особым в ногах скелета, такой стиль отмечен в захоронениях с Алтая.
Наличие в могиле бронзового и железного колокола без языков также указывает на древние традиции гуннов, что известно из знаменитых гуннских курганов НоинУла (Монголия). Из оружия был найден только железный нож. Возможно, что оружие было захоронено недалеко в отдельной могиле, что также было ранее отмечено в гуннских захоронениях. Все указывало на то, что найденный скелет мог принадлежать знатному человеку из элиты гуннов.
Антропологическая экспертиза проведена научным сотрудником Музея естественной истории Шандором Эвингером (г. Будапешт). Выбранный для обследования древний объект гуннского периода представляет собой скелет молодого мужчины, около 25 лет, ростом примерно 160 см, череп антропологически характеризуется европеоидно-монголоидными чертами. Скелет в верхней части до конца бедренной кости в хорошей сохранности. Голень, фибулы и кости стопы пропали без вести. Они, скорее всего, уничтожены во время случайного нарушения могилы строителями. В таблице 1 представлены суммированные сведения детального антропологического обследования. // Л. Б. Джансугурова, К. Б. Джантаева, Нуржибек, Г. С. Жунусова, Е. Б. Кузовлева, Л. З. Мусралина, Ш. Эвингер, А. Кустар, О. А. Иксан, Э. М. Хусаинова «Выделение и анализ древней ДНК из костных человеческих останков гуннского периода». / Известия национальной Академии Наук Республики Казахстан Института биологии и биотехнологии растений. Серия биологическая и медицинская. 4 (322). Июль—Август, 2017 г. Гл. ред. академик НАН РК, д. м. н., проф. Ж. А. Арзыкулов. Адрес типографии: ИП «Аруна», г. Алматы, ул. Муратбаева, 75. Алматы, НАН РК, 2017. С. 40
Таблица 1 — Данные антропологического обследования объекта № 12763
Материалы и методы исследования
Материалом для молекулярно-генетического анализа послужили костные останки гуннского периода из коллекции Департамента антропологии Венгерского музея естественной истории (Будапешт, Венгрия). Забор костных фрагментов для анализа ДНК проведен в лаборатории Департамента антропологии Венгерского музея естественной истории с соблюдением санитарно- гигиенических требований в предварительно обработанном ультрафиолетом (в течение 4 часов) помещении (рисунок 2).
Рисунок 2 — Забор костных фрагментов объекта № 12763 // Л. Б. Джансугурова, К. Б. Джантаева, Нуржибек, Г. С. Жунусова, Е. Б. Кузовлева, Л. З. Мусралина, Ш. Эвингер, А. Кустар, О. А. Иксан, Э. М. Хусаинова «Выделение и анализ древней ДНК из костных человеческих останков гуннского периода». / Известия национальной Академии Наук Республики Казахстан Института биологии и биотехнологии растений. Серия биологическая и медицинская. 4 (322). Июль—Август, 2017 г. Гл. ред. академик НАН РК, д. м. н., проф. Ж. А. Арзыкулов. Адрес типографии: ИП «Аруна», г. Алматы, ул. Муратбаева, 75. Алматы, НАН РК, 2017. С. 41
Выделение и очистка препаратов древней ДНК. Выделение древней ДНК проводили из 0,5—1 г костного порошка. Костный порошок получали путем ультразвуковой гомогенизации (30 Гц, 40 сек., Tissue Laser II) костных фрагментов. Костный порошок подвергали интенсивной декальцификации с использованием раствора 0,5 М ЭДТА (рН 8,0). Хорошо ресуспендировали и инкубировали на качалке (25 °C, Rpm 1000) в течение 1 часа. Центрифугировали 30 сек при 1000 об/мин, супернатант сливали. Затем промывали 1 мл деионизированной воды, хорошо ресуспендируя осадок. Опять центрифугировали в течение 30 сек при 1000 об/мин, супернатант сливали. Далее процедуру декальцинирования и промывки повторяли. После добавления 1 мл H2O осадок хорошо ресуспендировали и центрифугировали в течение 5 мин при 3000 об/мин. Осадок тщательно промывали водой 2 раза (1 мл), каждый раз хорошо ресуспендируя. Центрифугировали в течение 5 мин при 3000 об/мин. К оставшемуся гелеобразному осадку добавляли 1,5 мл лизирующего буфера TNES (10mM Tris-HCl, pH 7.5, 100 mM EDTA, pH 8.0, 50 mM NaCl, 2% SDS) и 5-6 мкл проназы К (100mg проназы в 5,5 мл в инкубационном буфереr, Promega, США). Инкубировали в лизисном буфере в течение 16-24 часов (ночь): при 56 °C — 1 час (400 RPM), 15-23 часа при 37 °C. Утром центрифугировали в течение 5 мин при 10000 об/мин и отбирали лизат в новые стерильные пробирки. Клеточный лизат разаликвочивали в пробирки (1,5-2 мл) по 500 мкл. ДНК осаждали с помощью набора реактивов «ДНК-Сорб-В» (Россия) согласно протоколу производителя. Потом центрифугировали при 12000 об/мин, 1 мин и отбирали надосадочную жидкость, представляющую собой раствор ДНК, который можно использовать для полимеразной цепной реакции (ПЦР).
Количественная и качественная оценка препаратов ДНК. Количественную и качественную оценку препаратов ДНК проводили с помощью спектрофотометрического и электрофоретического анализа. Для количественной и качественной оценки растворов ДНК использовали оборудование - Eppendorf BioPhotometer plus (Eppendorf, Германия) или NanoDrop 2000 (Thermo Scientific, США).
Для спектрофотометрического анализа проводили измерение адсорбции водных растворов ДНК при трех длинах волн: 260 нм, 280 нм и 320 нм. Чистоту (наличие примесей РНК и белка) препарата ДНК (D) определяли по коэффициенту: К=D260/D280. Для чистой ДНК К=1,8, для РНК соответствующий показатель — 2,0, для белка — 1,6 и ниже.
Концентрацию ДНК в водном растворе определяли по формуле:
С = (D260 — D320) х 50 х К разведения (мкг/мл),
где D260 — коэффициент поглощения при длине волны 260 нм; D320 — коэффициент поглощения при длине волны 320 нм; Кразведения — коэффициент разведения.
Размер молекул ДНК, также как наличие примесей РНК определяли методом электрофореза в 0,7% агарозном геле (50В, 299 мА, 1 час) после окрашивания бромистым этидием. Визуализация ДНК, РНК проводилась с использованием трансиллюминатора (Pharmacia, Германия) в ультрафиолетовом свете или системы гель-документирования Quantum ST5 (Vilber Lourmat, Германия).
Генотипирование ДНК по STR-маркерам Y-хромосомы. Генотипирование полиморфных 17 STR-локусов (DYS19, DYS389I, DYS389II, DYS390, DYS391, DYS392, DYS393, DYS385a, DYS385b, DYS437, DYS438, DYS439, DYS448, DYS456, DYS458, DYS635, GATA H4) Y-хромосомы, проводили в мультилокусном формате с помощью ПЦР с использованием системы энзиматической амплификации — набора AmpFlSTR YfilerTM (Life Technologies, США).
Полимеразную цепную реакцию проводили в ПЦР-боксе («LS» (Россия)) согласно протоколу изготовителя с использованием амплификатора «Mastercycler» фирмы «Eppendorf» (Германия). Смесь для амплификации объемом 25 мкл включала следующие компоненты: 10 мкл выделенной геномной ДНК (0,5 нг), 0,8 мкл (4 единиц) AmpliTaq Gold ДНК полимераза (Life Technologies, США), 9,2 мкл набора AmpFlSTR YfilerTM ПЦР реакционной смеси, а также 5 мкл набора праймеров AmpFlSTR YfilerTM. Для оценки специфичности реакции амплификации использовали положительный (контрольная ДНК с известными генетическими признаками из набора реагентов) и отрицательный (проба без ДНК) контроли. Стандартные условия ПЦР-амплификации состоял из ферментативной активации в течение 11 мин при 95 °C, затем следовал блок из 30 циклов: денатурация при 94 °C в течение 1 мин, отжиг при 61 °C в течение 1 мин и удлинение при 72 °C в течение 1 мин. Финальное удлинение осуществлялась при 60 °C в течение 80 мин. // Л. Б. Джансугурова, К. Б. Джантаева, Нуржибек, Г. С. Жунусова, Е. Б. Кузовлева, Л. З. Мусралина, Ш. Эвингер, А. Кустар, О. А. Иксан, Э. М. Хусаинова «Выделение и анализ древней ДНК из костных человеческих останков гуннского периода». / Известия национальной Академии Наук Республики Казахстан Института биологии и биотехнологии растений. Серия биологическая и медицинская. 4 (322). Июль—Август, 2017 г. Гл. ред. академик НАН РК, д. м. н., проф. Ж. А. Арзыкулов. Адрес типографии: ИП «Аруна», г. Алматы, ул. Муратбаева, 75. Алматы, НАН РК, 2017. С. 42
Анализ продуктов амплификации. В наборе AmpFlSTR YfilerTM содержится красители, ис- пользуемые для мечения амплифицируемых продуктов: 6-FAM, VIC, NED, PET и LIZ. Продукты амплификации разделяли и определяли на генетическом анализаторе ABI PRISM 310 (Applied Biosystems, США), используя определенный G5 вариабельный биннинговый модуль, как описано в руководстве пользователя. Подготовка образцов и электрофорез на анализаторе ABI PRISM 310 происходил следующим образом: 1 мкл амплифицированного продукта или аллельного лэддера (маркера) и 0,3 мкл 500 LIZ стандартного размера GeneScanTM добавляли к 8,7 мкл деионизован- ному Hi-DiTM формамиду (Applied Biosystems, США), денатурировали при 95°C в течение 3 мин, а затем охлаждали на льду в течение 3 мин. Образцы вводились в течение 10 сек при 5 кВ и под- вергались к электрофорезу при 15 кВ в оптимизированном полимере (POP-4TM полимер) с запус- ком при 60 °C температуре, как указано в GeneScan36vb_POP4DyeSetG5Module. Идентификацию аллелей проводили с помощью программного обеспечения «GeneMapperID» ID-X v1.4 на основе входящих в состав наборов аллельных лэддеров.
Определение гаплотипов Y-хромосомы. Гаплогруппы по У-хромосоме были определены на сайте «Whit Athey's Haplotype Predictor» ([url]http://www.hprg.com[/url]). Процентное соотношение вероят- ности к тем или иным гаплогруппам различается в зависимости от выбора программы (программы по количеству маркеров и гаплогрупп).
Гаплотип определяли с помощью программы «27-Haplogroup Program» для 27 гаплотипов ([url]http://www.hprg.com/hapest5/hapest5b/hapest5.htm[/url]) с учетом максимально известного числа гаплотипов по STR-маркерам.
ПЦР-амплификация гипервариабельных районов митохондриальной ДНК. ПЦР-амплифи- кацию для секвенирования нового поколения (NGS — next generation sequencing) проводили в четырех отдельных реакциях на образец в соответствии с протоколом Human mtDNA D-Loop Hypervariable Region (Illumina, San Diego, CШA) [2] для создания четырех ампликонов, представляющих 2 гипервариабельных района кольцевой митохидриальной ДНК (HVRR1, HVRR2) по следующим позициям нуклеотидов: 29-285, 172-408, 15997-16236 и 16159-16401. Для ПЦР каждый образец палео-ДНК ставили в двух повторностях, в разные дни и разными людьми. Количество и качество ПЦР ампликонов определяли с помощью электрофореза и QuantusTM Fluorometer. ДНК ампликоны нормализовали до 0,2 нг/мкл. и объединяли в соотношении 1: 1: 1: 1 в общей сложности на 20 мкл (5 мкл каждая). Для каждого палео-образца ДНК всего проведено по 10 независимых ПЦР-реакций образцов палео-ДНК, где в качестве источника ДНК использовали разные фрагменты костной ткани (2-3 фрагмента), выделение ДНК и ПЦР реакция проводились разными людьми (5 человек) и в разное время с соблюдением всех санитарно-гигиенических требований для работы с палео-ДНК. Повторение результата не менее 5 раз фиксировали как результат.
Полногеномное секвенирование древней ДНК и биоинформационный анализ результатов секвенирования мтДНК. Из препаратов изолированной палео-ДНК была приготовлена ДНК-биб- лиотека согласно модифицированному протоколу Illumina [2]. Библиотека была секвенирована на платформе Illumina Genome Analyser IIx согласно методике производителя.
Для определения гаплогрупп использовалось программное обеспечение — mtDNA manager [3]. Для анализа полногеномной секвенированной последовательности мтДНК и определения гаплотипов мтДНК также были использованы программы Haplofind ([url]https://haplofind.unibo.it[/url]) и Bioedit ([url]http://www.mbio.ncsu.edu/bioedit/page2.html[/url])..
Результаты исследования и их обсуждение
Для получения препаратов древней ДНК в данной работе мы использовали фрагменты большой берцовой кости посткраниального скелета (инвентарный № 12763) гуннского периода из коллекции Департамента антропологии Венгерского музея естественной истории. Одна из главных проблем при выделении палео-ДНК заключается в опасности загрязнения древнего материала современными образцами ДНК. Для предотвращения возможной контаминации образцов, все манипуляции с костными фрагментами, процедуры выделения и анализа образцов палео-ДНК проводили в стерильных условиях. Этапы предобработки костных фрагментов демонстрирует рисунок 3. // Л. Б. Джансугурова, К. Б. Джантаева, Нуржибек, Г. С. Жунусова, Е. Б. Кузовлева, Л. З. Мусралина, Ш. Эвингер, А. Кустар, О. А. Иксан, Э. М. Хусаинова «Выделение и анализ древней ДНК из костных человеческих останков гуннского периода». / Известия национальной Академии Наук Республики Казахстан Института биологии и биотехнологии растений. Серия биологическая и медицинская. 4 (322). Июль—Август, 2017 г. Гл. ред. академик НАН РК, д. м. н., проф. Ж. А. Арзыкулов. Адрес типографии: ИП «Аруна», г. Алматы, ул. Муратбаева, 75. Алматы, НАН РК, 2017. С. 43
Рисунок 3 — Предобработка древних костных фрагментов перед выделением палео-ДНК:
А-Г — очистка от верхнего слоя; Д — ультразвуковая гомогенизация; Е-Ж — декальцинирование образцов
Древние археологические материалы содержат очень малые количества ДНК, которая обычно сильно фрагментирована. С целью оптимизации процедуры выделения древней ДНК мы использовали различные модификации лизирующего буфера и варьировали время декальцинирования и последующей инкубации в лизирующем буфере, что отразилось на качестве препаратов палео- ДНК. Качественные и количественные характеристики образцов ДНК оценивали с помощью методов спектро- и фотометрического анализов. На рисунке 4 и в таблице 2 представлены качественные и количественные характеристики выделенных образцов палео-ДНК.
Анализ полученных препаратов древней ДНК показал, что все образцы представляют собой высокомолекулярную ДНК, однако наилучшим качеством характеризовались образцы с кодовыми номерами Г-3 и Г-6. Именно они были в дальнейшем использованы для ПЦР-анализа.
Рисунок 4 – Электрофореграмма выделенных образцов палео-ДНК. // Л. Б. Джансугурова, К. Б. Джантаева, Нуржибек, Г. С. Жунусова, Е. Б. Кузовлева, Л. З. Мусралина, Ш. Эвингер, А. Кустар, О. А. Иксан, Э. М. Хусаинова «Выделение и анализ древней ДНК из костных человеческих останков гуннского периода». / Известия национальной Академии Наук Республики Казахстан Института биологии и биотехнологии растений. Серия биологическая и медицинская. 4 (322). Июль—Август, 2017 г. Гл. ред. академик НАН РК, д. м. н., проф. Ж. А. Арзыкулов. Адрес типографии: ИП «Аруна», г. Алматы, ул. Муратбаева, 75. Алматы, НАН РК, 2017. С. 44
Таблица 2 — Характеристики выделенных палео-ДНК
Генотипирование по маркерам Y-хромосомы древних костных останков гуннского периода из Венгрии, определение гаплотипа. Для разрешения вопросов генеалогии, принадлежности к конкретной популяции, генетического разнообразия и эволюционных процессов в современной практике используют микросателлитные STR-локусы, позволяющие почти со 100% достоверностью определять близких родственников [1].
Генотипирование древней ДНК проводили по 17 микросателлитам Y-хромосомы. STR-аллели были определены в нескольких независимых воспроизведениях ПЦР с использованием не менее трех различных экстракций ДНК. Аутентичными считались только аллели, проявившиеся мини- мум в двух повторных анализах. При этих условиях был получен профиль для костных образцов исследуемого скелета. Результаты проведенного анализа представлены на рисунке 5 и в таблице 3.
Рисунок 5 — Результаты генотипирования аппаратно-программным комплексом 310 Genetic Analyzer (Applied Biosystems, США) // Л. Б. Джансугурова, К. Б. Джантаева, Нуржибек, Г. С. Жунусова, Е. Б. Кузовлева, Л. З. Мусралина, Ш. Эвингер, А. Кустар, О. А. Иксан, Э. М. Хусаинова «Выделение и анализ древней ДНК из костных человеческих останков гуннского периода». / Известия национальной Академии Наук Республики Казахстан Института биологии и биотехнологии растений. Серия биологическая и медицинская. 4 (322). Июль—Август, 2017 г. Гл. ред. академик НАН РК, д. м. н., проф. Ж. А. Арзыкулов. Адрес типографии: ИП «Аруна», г. Алматы, ул. Муратбаева, 75. Алматы, НАН РК, 2017. С. 45
Таблица 3 — Анализ STR-гаплотипов Y-хромосомы
Для низкокопийной высокодеградированной ДНК часты выпадающие аллели для STR-маркеров. Как видно из вышеприведенных данных в таблице 3, для исследуемого образца не указаны аллели следующих четырех маркеров: DYS390, DYS391, DYS392, DYS448. Данные аллели формально обозначены нами как неопределенные (ND), поскольку в трех повторяющихся экспериментах с исследуемой ДНК аллели этих маркеров наблюдались только один раз.
Анализ распределения установленных аллелей позволил определить STR-гаплотип Y-хромосомы. Результаты пробного генотипирования показали, что исследуемые костные останки гуннского периода могут характеризоваться 100% по L гаплотипу Y-хромосомы.
Происхождение данной гаплогруппы связывается с Южной Азией, с западом полуострова Индостан. В настоящее время гаплогруппа L присутствует в индийской популяции при общей частоте около 7-15%. Особенно часто встречается среди дравидских высших и средних каст (примерно 17-19%), несколько реже среди племенных групп Индии (примерно 5,6-7%). Но самая высокая частота встречаемости гаплогруппы L и разнообразия ее подклассов отмечается в западной части Пакистана в Белуджистане (28%) [4-8].
Особенно интересным является встречаемость гаплогруппы L у современных казахов. Согласно нашим исследованиям по определению STR-гаплотипов Y-хромосомы у современных казахов (изучено 748 человек казахской национальности), гаплогруппа L с высокой частотой встречается у представителей Среднего жуза, относящихся к роду Аргын. Интересно, что в 2009 году венгерскими учеными было выявлено наличие общих гаплотипов Y-хромосомы в популяции казахских аргын (подрод мадьяр) и венгерских мадьяр, имеющих гуннское происхождение. На основе полученных данных было выдвинуто предположение о вероятной генетической связи казахов с венграми в прошлом [9]. В настоящее время исследования в данном направлении продолжаются в лаборатории популяционной генетики Института общей генетики и цитологии.
Генотипирование мтДНК древних костных останков гуннского периода из Венгрии, определение гаплотипа. Для анализа мтДНК использовали образцы палео-ДНК древнего объекта гуннского периода из Венгрии, экстрагированные из фрагментов костной ткани большой берцовой кости и зуба.
Анализ проводили с использованием секвенирования нового поколения (NGS) на генетичес- ком анализаторе MiSeq (Illumina), в результате удалось прочитать всю последовательность мтДНК и установить следующие мутации и полиморфизмы при сравнении с референсной последователь- ностью: 1.Del(G), 73G, 263G, 311С/T, 489C, 750G, 1438G, 2706G, 3010A, 4769G, 4883T, 5178A, 5973A, 7028T, 7353G, 8273T, 8414T, 87701G, 8860G, 9540C, 10398G, 10400T, 10873C, 11696A, 11719A, 12705T, 14468T, 14766T, 14783C, 15043A, 15300A, 15326G, 15470C, 16223T, 16362C.
С помощью программного обеспечения Haplofind была определена гаплогруппа мтДНК древнего объекта гуннского периода из Венгерского музея естественной истории:
D4j12 гаплотип. Филогения этого гаплотипа (ключевые мутации, определяющие происхождение гаплотипа мтДНК): // Л. Б. Джансугурова, К. Б. Джантаева, Нуржибек, Г. С. Жунусова, Е. Б. Кузовлева, Л. З. Мусралина, Ш. Эвингер, А. Кустар, О. А. Иксан, Э. М. Хусаинова «Выделение и анализ древней ДНК из костных человеческих останков гуннского периода». / Известия национальной Академии Наук Республики Казахстан Института биологии и биотехнологии растений. Серия биологическая и медицинская. 4 (322). Июль—Август, 2017 г. Гл. ред. академик НАН РК, д. м. н., проф. Ж. А. Арзыкулов. Адрес типографии: ИП «Аруна», г. Алматы, ул. Муратбаева, 75. Алматы, НАН РК, 2017. С. 46
Все ключевые мутации, свидетельствующие о филогении D4j12 гаплотипа мтДНК присутствуют в определенном нами гаплотипе.
Филогенетический анализ показывает, что гаплогруппа D возникла в Азии около 60 тыс. лет тому назад. Она является потомком гаплогруппы M. Считается, что гаплогруппа D, также как и С, на территорию северной Азии распространилась в позднеледниковый период из южного Китая через северо-восток Индии [10]. Кроме того, из-за их высокой частоты и широкого распро- странения, гаплогруппы C и D, скорее всего, принимали участие во всех последующих эпизодах предполагаемого потока генов в восточной и северной части Евразии. К ним относятся палео- литическая колонизация Сибири (40-30 тысяч лет назад), дальнейшая реколонизация и возможная замена популяций ранних сибиряков внедрением популяций от побережья озера Байкал, бассейнов рек Енисей и Лена (20 тысяч лет назад), появление неолитической традиции гончарного искусства в лесостепной полосе северной Евразии (начиная примерно 14,5 тысяч лет назад) и ее расширение в Восточно-Европейской равнине (7 тысяч лет назад), неолитическое рассредоточение сельского хозяйства в восточной Азии, расширение Афанасьевской и Андроновской культур (5-3 тысяч лет назад) и более поздних событий, определяющих поток генов в восточной и центральной Евразии [11].
На территории Евразии гаплогруппа D встречается в Северо-Западной Азии, в том числе в Сибири. Также гаплогруппа D довольно часто встречается в Центральной Азии, где она является второй по частоте кладой мтДНК (после H), с низкой частотой гаплогруппа D встречается на северо-востоке Европы и юго-западе Азии [10-12]. Известно, что эта гаплогруппа является одной из 5 мтДНК-гаплогрупп, обнаруженных у коренных народов Америки [13], наряду с такими, как A, B, C и X. Гаплогруппа D мтДНК охватывает почти 20% от общего изменения мтДНК в большинстве северной Азии и сохраняет очень высокую общую частоту среди северных азиатских групп (11-34%), населения Центральной Азии (14-20%) и Восточной Азии (10-43%) [11]. Ее частота снижается на запад и на юг, до 2% или менее, в Индии и Западной Азии, но на Кавказе, Волго-Уральского региона и Юго-Восточной Азии по-прежнему достигает 5-10%. Интересно, что гаплогруппа D встречается также в некоторых северо-восточных европейцев, как карелов, саамов и скандинавов, в то время как гаплогруппа C отсутствует среди них [11].
Aнализ древнего материала показал, что гаплогруппа D мтДНК была обнаружена у мужчины-воина из погребения в Покровске (Якутия), жившего 2400-2200 лет до н.э. [14]. У девочки-подростка из пещеры Хойо Негро (полуостров Юкатан), жившей 13-12 тыс. лет до н.э., была митохондриальная гаплогруппа D1 [15]. Мужчина и женщина хунну из Северо-Восточной Монголии (местность Duurlig Nars), жившие 2000 лет назад, оказались обладателями митохондриальной гаплогруппы D4 [16].
Анализ специфических мутаций гипервариабельных районов мтДНК показал, что возраст главных субкладов D гаплогруппы мтДНК — D4 и D6, очень древний (24-28 тысяч лет назад и 23-42 тысяч лет назад, соответственно) [13]. D4 является наиболее представительной группой и имеет 15 субгрупп, которые по скорости синонимичных мутаций мтДНК можно оценить в пределах 3-42 тысячи лет назад. Практически все субклады D4 встречаются в Восточной Азии, однако распространены и на территории Северной и Южной Азии. Некоторые из этих субкладов имеют очень // Л. Б. Джансугурова, К. Б. Джантаева, Нуржибек, Г. С. Жунусова, Е. Б. Кузовлева, Л. З. Мусралина, Ш. Эвингер, А. Кустар, О. А. Иксан, Э. М. Хусаинова «Выделение и анализ древней ДНК из костных человеческих останков гуннского периода». / Известия национальной Академии Наук Республики Казахстан Института биологии и биотехнологии растений. Серия биологическая и медицинская. 4 (322). Июль—Август, 2017 г. Гл. ред. академик НАН РК, д. м. н., проф. Ж. А. Арзыкулов. Адрес типографии: ИП «Аруна», г. Алматы, ул. Муратбаева, 75. Алматы, НАН РК, 2017. С. 47
характерное географическое распределение, что весьма информативно для анализа геногеографии азиатских народов. Среди современного населения Евразии D4 гаплогруппа мтДНК часто встречается у бурят и хамниган из Бурятии, калмыков из Калмыкии, теленгитов и казахов Алтая. Субклад распространен в Китае, Юго-Восточной Азии, Сибири и Центральной Азии. Также он обнаружен у коренного населения Америки [11].
Согласно данным Деренко с соавторами (2010) по общей скорости мутирования митохондриального генома считается, что D4j гаплогруппа могла возникнуть более 16 тысяч лет назад [11]. По анализу синонимичных мутаций — 17.84 ± 5.11 тысяч лет назад.
Возраст субклада D4j12 оценить пока не представляется возможным, поскольку в известных базах данных и в литературе [11, 17, 18] описано пока только несколько примеров встречаемости этого субклада у современного населения: всего 4, из них 2 относятся к европейским популяциям (женщина из Литвы, 1 скандинав) и 2 к азиатским (1 баргут и 1 бурят из Алтая). Пока неизвестно примеров встречаемости этого субклада у современных казахов.
Тем не менее, наличие этой гаплогруппы у древнего объекта гуннской элиты из Венгрии может свидетельствовать об азиатском происхождении гуннов. В этой связи анализ современных и древних образцов стоит продолжать, поскольку налицо широкий географический разброс (от Восточной Азии до Скандинавии) и редкая встречаемость D4j12 гаплогруппы мтДНК, возможно, свидетельствует о богатстве миграционной истории древних гуннских племен по территории Евразии и низкой репродуктивной активности женских веток древних гуннов.
Легенды гласят, что во время нашествия гуннов в Паннонию, гунны убивали мужчин и насиловали женщин. Таким образом, даже в гуннских ветках современных венгров должен очень слабо читаться «гуннский материнский след».
Как показывают исследования гипервариабельных районов, мтДНК древнего и современного населения Венгрии (27 древних образцов (10-11 веков), 101 современный венгр, и 76 современных образцов обособленной популяции венгров — Sekler из Трансильвании) [19]. Данные были сравнены с 57 популяциями европейских и азиатских народов. Обнаружено, что 2 из 27 древних венгерских образцов однозначно имеют азиатское происхождение, остальные принадлежат к одному из западных гаплогрупп, но имеют некоторое сродство с азиатами. Современное население Венгрии демонстрирует преобладание H, R, T гаплогрупп мтДНК, но по социальному статусу и семейной истории предки этой части населения относились к племенам, обитавшим на территории Венгрии до гуннского нашествия. В то время как гуннские древние образцы и современные потомки имеют гаплогруппы N1a и X, которые обнаруживаются с очень низкой частотой в современных популяциях по всему миру. Как известно, гаплогруппа D4 была обнаружена у древних хунну из Монголии [14]. Свидетельств о встречаемости D4j субклада у древних гуннов с территории Венгрии еще не было.
В целом по ДНК-анализу древнего объекта гуннского периода из Венгерского музея естественной истории можно заключить, что и отцовская линия (Y-хромосомный гаплотип L) и материнская линия (мтДНК гаплотип D4j12) свидетельствуют об азиатском происхождении гуннов. Причем распространенность данных отцовских и материнских линий у современного населения северной Индии, Пакистана и Ирана дает основание предположить возможность миграций древних людей с Передней Азии в Центральную и Восточную Азию через Тибет.
Источник финансирования исследований. Работа была выполнена в рамках научного проекта «Изучение этногенетической истории населения Казахстана», финансируемого АО «Фонд Науки» на 2014–2016 гг. и научного гранта Г.2015 по теме: «Анализ генетической связи между потомками прото-казахской популяции аргын и древними костными останками гуннского периода из Венгрии», финансируемой Государственным учреждением «Комитет науки Министерства образования и науки Республики Казахстан» на 2015–2017 гг.
ЛИТЕРАТУРА
[1] — Кравцова О. А., Нечвалода А. И. Молекулярно-генетический анализ человеческих останков золотоордынского времени из мавзолея Хусейнбека // Уфимский археологический вестник. Вып. 6-7. 2007. С. 195-199.
[2] — Meyer, M. & Kircher, M. Illumina sequencing library preparation for highly multiplexed target capture and sequencing. Cold Spring Harb. Protoc. 2010, doi:10.1101/pdb.prot5448 (2010).[/SIZE] // Л. Б. Джансугурова, К. Б. Джантаева, Нуржибек, Г. С. Жунусова, Е. Б. Кузовлева, Л. З. Мусралина, Ш. Эвингер, А. Кустар, О. А. Иксан, Э. М. Хусаинова «Выделение и анализ древней ДНК из костных человеческих останков гуннского периода». / Известия национальной Академии Наук Республики Казахстан Института биологии и биотехнологии растений. Серия биологическая и медицинская. 4 (322). Июль—Август, 2017 г. Гл. ред. академик НАН РК, д. м. н., проф. Ж. А. Арзыкулов. Адрес типографии: ИП «Аруна», г. Алматы, ул. Муратбаева, 75. Алматы, НАН РК, 2017. С. 48
[3] — Hwan Young Lee, Injee Song, Eunho Ha, Sung-Bae Cho, Woo Ick Yang and Kyoung-Jin Shin. mtDNAmanager: a Webbased tool for the management and quality analysis of mitochondrial DNA control-region sequences // BMC Bioinformatics. 2008. Vol. 9, N. 483. doi: 10.1186/1471-2105-9-483.
[4] — Basu A., Mukherjee N., Roy S., Sengupta S., Banerjee S., Chakraborty M., Dey B., Roy M., Roy B., Bhattacharyya N.P., Roychoudhury S., Majumder P.P. Ethnic India: a genomic view, with special reference to peopling and structure // Genome Res. 2003. No13(10). Р. 2277-2290.
[5] — Cordaux R. et al. Independent Origins of Indian Caste and Tribal Paternal Lineages // Current Biology. 2004. Vol. 14. Р. 231-235.
[6] — Sengupta S. et al. Polarity and Temporality of High-Resolution Y-Chromosome Distributions in India Identify Both Indigenous and Exogenous Expansions and Reveal Minor Genetic Influence of Central Asian Pastoralists // American Journal of Human Genetics. 2006. P. 202-221.
[7] — Thanseem I., Thangaraj K., Chaubey G., Singh V. K., Bhaskar L. V., Reddy B. M., Reddy A. G., Singh L. Genetic affinities among the lower castes and tribal groups of India: inference from Y chromosome and mitochondrial DNA // BMC Genet. 2006. P.7-42.
[8] — Qamar R. et al. Y-Chromosomal DNA Variation in Pakistan // American Journal of Human Genetics. 2002. P. 1107-1124.
[9] — Bíró A.Z., Zalán A., Völgyi A., Pamjav H. A Y-chromosomal comparison of the Madjars (Kazakhstan) and the Magyars (Hungary) // American Journal of Physical Anthropology. 2009. V.139. Is. 3. P. 305-310.
[10] — Kong Q.P., Yao Y.G., Sun C., Bandelt H.J., Zhu C.L., et al. Phylogeny of East Asian mitochondrial DNA liner ages inferred from complete sequences // Am. J. Hum. Genet. 2003. Vol. 73. P. 671–676.
[11] — Derenko M., Malyarchuk B., Grzybowski T., Denisova G., Rogalla U., Perkova M., Dambueva I. and Zakharov I. Origin and Post-Glacial Dispersal of Mitochondrial DNA Haplogroups C and D in Northern Asia // PLoS ONE. 2010. Vol. 5, Is. 12. e15214+
[12] — Volodko N.V., Starikovskaya E.B., Mazunin I.O. et al. Mitochondrial Genome Diversity in Arctic Siberians, with Particular Reference to the Evolutionary History of Beringia and Pleistocenic Peopling of the Americas // The American Journal of Human Genetics. - 2008. Vol. 82. P. 1084–1100. DOI 10.1016/j.ajhg.2008.03.019.
[13] — Comas D., Plaza S., Wells R.S., Yuldaseva N., Lao O., Calafell F., Bertranpetit J. Admixture, migrations, and dispersals in Central Asia: evidence from maternal DNA lineages // European Journal of Human Genetics. - 2004. Vol. 12, N. 6. P. 495-504.
[14] — Amory S., Crubézy E., Keyser C., Alekseev A.N., Ludes B. Early influence of the steppe tribes in the peopling of Siberia // Human Biology. 2006. Vol. 78, N. 5. P. 531–549.
[15] — James C. Chatters, Douglas J. Kennett, Yemane Asmerom, Brian M. Kemp, Victor Polyak, Alberto Nava Blank, Patricia A. Beddows, Eduard Reinhardt, Joaquin Arroyo-Cabrales, Deborah A. Bolnick, Ripan S. Malhi, Brendan J. Culleton, Pilar Luna Erreguerena, Dominique Rissolo, Shanti Morell-Hart, Thomas W. Stafford Jr. Late Pleistocene Human Skeleton and mtDNA Link Paleoamericans and Modern Native Americans // Science. 2014. Vol. 344, Is. 6185. P. 750-754. DOI: 10.1126/science.1252619
[16] — Behar D.M., van Oven M., Rosset S., Metspalu M., Loogväli E.L., Silva N.M., Kivisild T., Torroni A. and Villems R. A “Copernican” reassessment of the human mitochondrial DNA tree from its root. // American J. Human Genetics. 2012. Vol. 90, N. 4. P. 675-684.
[17] — Zheng, H. X., Yan, S., Qin, Z. D., & Jin, L. MtDNA analysis of global populations support that major population expansions began before Neolithic Time // Nature Scientific Reports. – 2012. Vol. 2. doi:10.1038/srep00745
[18] — Pankratov V, Litvinov S, Kassian A, et al. East Eurasian ancestry in the middle of Europe: genetic footprints of Steppe nomads in the genomes of Belarusian Lipka Tatars // Scientific Reports. 2016. – Vol. 6:30197. doi:10.1038/srep30197.
[19] — Tömöry G., Csányi B., Bogácsi-Szabó E., Kalmár T., Czibula A., Csosz A., Priskin K., Mende B., Langó P., Downes C.S., Raskó I. Comparison of maternal lineage and biogeographic analyses of ancient and modern Hungarian populations // American Journal of Physical Anthropology. 2007. Vol.134, Is. 3. P. 354-368. // Л. Б. Джансугурова, К. Б. Джантаева, Нуржибек, Г. С. Жунусова, Е. Б. Кузовлева, Л. З. Мусралина, Ш. Эвингер, А. Кустар, О. А. Иксан, Э. М. Хусаинова «Выделение и анализ древней ДНК из костных человеческих останков гуннского периода». / Известия национальной Академии Наук Республики Казахстан Института биологии и биотехнологии растений. Серия биологическая и медицинская. 4 (322). Июль—Август, 2017 г. Гл. ред. академик НАН РК, д. м. н., проф. Ж. А. Арзыкулов. Адрес типографии: ИП «Аруна», г. Алматы, ул. Муратбаева, 75. Алматы, НАН РК, 2017. С. 49
http://nauka-nanrk.kz/ru/assets/журнал%202017%204/Биология_04_2017__Готов.pdf
Л. Б. Джансугурова 1, К. Б. Джантаева 1, Нуржибек 1, Г. С. Жунусова 1, Е. Б. Кузовлева 1, Л. З. Мусралина 1, Ш. Эвингер 2, А. Кустар 2, О. А. Иксан 1, Э. М. Хусаинова 1
1 — Лаборатория популяционной генетики, РГП «Институт общей генетики и цитологии» КН МОН РК, Алматы, Казахстан,
2 — Департамент антропологии, Венгерский музей естественной истории, Будапешт, Венгрия
«Выделение и анализ древней ДНК из костных человеческих останков гуннского периода»
Аннотация.
Проведен палеогенетический анализ человеческих останков гуннского периода. Показано, что костные останки гуннского периода из Венгрии 100% характеризуются по L гаплотипу Y-хромосомы и D4j12 гаплотипу мтДНК, что является свидетельством азиатского происхождения отцовской и материнской линии древней находки из Европы.
Ключевые слова: палеогенетика, древняя ДНК, этногенетические реконструкции, популяционная генетика, гаплотип.
В настоящее время популяционная генетика нуждается в таком же систематическом изучении генофонда древнего населения, как и населения современного, причем исследование древнего генофонда требует с самого начала комплексного подхода со стороны генетики, археологии и палеоантропологии. Стремительное развитие технологий и методов молекулярной биологии позволило обратиться к новому объекту исследования — древней ДНК (палео-ДНК). Возможность применения в комплексных междисциплинарных исследованиях методов анализа древней ДНК из музейного, коллекционного материала и археологических находок является актуальной для широкого круга специалистов разных областей науки и значительно дополняет традиционные анализы антропологического материала [1]. Однако древняя ДНК находится в палеоматериале в следовых количествах, что обуславливает одну из важнейших проблем при ее исследовании — // Л. Б. Джансугурова, К. Б. Джантаева, Нуржибек, Г. С. Жунусова, Е. Б. Кузовлева, Л. З. Мусралина, Ш. Эвингер, А. Кустар, О. А. Иксан, Э. М. Хусаинова «Выделение и анализ древней ДНК из костных человеческих останков гуннского периода». / Известия национальной Академии Наук Республики Казахстан Института биологии и биотехнологии растений. Серия биологическая и медицинская. 4 (322). Июль—Август, 2017 г. Гл. ред. академик НАН РК, д. м. н., проф. Ж. А. Арзыкулов. Адрес типографии: ИП «Аруна», г. Алматы, ул. Муратбаева, 75. Алматы, НАН РК, 2017. С. 39
проблему аутентичности получаемых результатов. В лаборатории популяционной генетики Института общей генетики и цитологии ведется работа по апробации на реальных образцах методик выделения и амплификации аутентичных препаратов древней ДНК, и непосредственное применение методов исследования древней ДНК человека и животных для решения конкретных научных задач в рамках комплексных междисциплинарных исследований.
Целью данной работы является молекулярно-генетический анализ костных человеческих останков гуннского периода из коллекции Департамента антропологии Венгерского музея естественной истории (г. Будапешт, Венгрия).
Палеоантропологический контекст. В коллекции Департамента антропологии Венгерского музея естественной истории имеется более 1000 скелетов гуннского периода. Основываясь на историко-археологических данных (описание захоронения, одежды, оружия и сопутствующих предметов), данных антропологического исследования, а, главное, сохранности костных останков и отсутствии агрессивной химической обработки материала, для палеогенетического исследования нами был выбран объект с инвентарным номером 12763. Данная находка была обнаружена в 1961 г. во время реконструкционных работ в г. Будапешт и датируется средней третью V века н. э. (конец гунского периода в Карпатском бассейне).
В могиле был скелет молодого человека, череп лошади, фрагменты конского убранства и дорогой одежды, инкрустированные золотыми бляшками и гранатами (рисунок 1).
Рисунок 1 — Схема расположения погребения объекта № 12763 и предметы, найденные в погребении
Стиль погребения c дорогим инвентарем указывает на тесную связь с сарматско-гуннскими погребениями, обнаруженными в Понтийской степи, в Крыму, на Кубани и Северном Каспии. Череп лошади был размещен особым в ногах скелета, такой стиль отмечен в захоронениях с Алтая.
Наличие в могиле бронзового и железного колокола без языков также указывает на древние традиции гуннов, что известно из знаменитых гуннских курганов НоинУла (Монголия). Из оружия был найден только железный нож. Возможно, что оружие было захоронено недалеко в отдельной могиле, что также было ранее отмечено в гуннских захоронениях. Все указывало на то, что найденный скелет мог принадлежать знатному человеку из элиты гуннов.
Антропологическая экспертиза проведена научным сотрудником Музея естественной истории Шандором Эвингером (г. Будапешт). Выбранный для обследования древний объект гуннского периода представляет собой скелет молодого мужчины, около 25 лет, ростом примерно 160 см, череп антропологически характеризуется европеоидно-монголоидными чертами. Скелет в верхней части до конца бедренной кости в хорошей сохранности. Голень, фибулы и кости стопы пропали без вести. Они, скорее всего, уничтожены во время случайного нарушения могилы строителями. В таблице 1 представлены суммированные сведения детального антропологического обследования. // Л. Б. Джансугурова, К. Б. Джантаева, Нуржибек, Г. С. Жунусова, Е. Б. Кузовлева, Л. З. Мусралина, Ш. Эвингер, А. Кустар, О. А. Иксан, Э. М. Хусаинова «Выделение и анализ древней ДНК из костных человеческих останков гуннского периода». / Известия национальной Академии Наук Республики Казахстан Института биологии и биотехнологии растений. Серия биологическая и медицинская. 4 (322). Июль—Август, 2017 г. Гл. ред. академик НАН РК, д. м. н., проф. Ж. А. Арзыкулов. Адрес типографии: ИП «Аруна», г. Алматы, ул. Муратбаева, 75. Алматы, НАН РК, 2017. С. 40
Таблица 1 — Данные антропологического обследования объекта № 12763
Материалы и методы исследования
Материалом для молекулярно-генетического анализа послужили костные останки гуннского периода из коллекции Департамента антропологии Венгерского музея естественной истории (Будапешт, Венгрия). Забор костных фрагментов для анализа ДНК проведен в лаборатории Департамента антропологии Венгерского музея естественной истории с соблюдением санитарно- гигиенических требований в предварительно обработанном ультрафиолетом (в течение 4 часов) помещении (рисунок 2).
Рисунок 2 — Забор костных фрагментов объекта № 12763 // Л. Б. Джансугурова, К. Б. Джантаева, Нуржибек, Г. С. Жунусова, Е. Б. Кузовлева, Л. З. Мусралина, Ш. Эвингер, А. Кустар, О. А. Иксан, Э. М. Хусаинова «Выделение и анализ древней ДНК из костных человеческих останков гуннского периода». / Известия национальной Академии Наук Республики Казахстан Института биологии и биотехнологии растений. Серия биологическая и медицинская. 4 (322). Июль—Август, 2017 г. Гл. ред. академик НАН РК, д. м. н., проф. Ж. А. Арзыкулов. Адрес типографии: ИП «Аруна», г. Алматы, ул. Муратбаева, 75. Алматы, НАН РК, 2017. С. 41
Выделение и очистка препаратов древней ДНК. Выделение древней ДНК проводили из 0,5—1 г костного порошка. Костный порошок получали путем ультразвуковой гомогенизации (30 Гц, 40 сек., Tissue Laser II) костных фрагментов. Костный порошок подвергали интенсивной декальцификации с использованием раствора 0,5 М ЭДТА (рН 8,0). Хорошо ресуспендировали и инкубировали на качалке (25 °C, Rpm 1000) в течение 1 часа. Центрифугировали 30 сек при 1000 об/мин, супернатант сливали. Затем промывали 1 мл деионизированной воды, хорошо ресуспендируя осадок. Опять центрифугировали в течение 30 сек при 1000 об/мин, супернатант сливали. Далее процедуру декальцинирования и промывки повторяли. После добавления 1 мл H2O осадок хорошо ресуспендировали и центрифугировали в течение 5 мин при 3000 об/мин. Осадок тщательно промывали водой 2 раза (1 мл), каждый раз хорошо ресуспендируя. Центрифугировали в течение 5 мин при 3000 об/мин. К оставшемуся гелеобразному осадку добавляли 1,5 мл лизирующего буфера TNES (10mM Tris-HCl, pH 7.5, 100 mM EDTA, pH 8.0, 50 mM NaCl, 2% SDS) и 5-6 мкл проназы К (100mg проназы в 5,5 мл в инкубационном буфереr, Promega, США). Инкубировали в лизисном буфере в течение 16-24 часов (ночь): при 56 °C — 1 час (400 RPM), 15-23 часа при 37 °C. Утром центрифугировали в течение 5 мин при 10000 об/мин и отбирали лизат в новые стерильные пробирки. Клеточный лизат разаликвочивали в пробирки (1,5-2 мл) по 500 мкл. ДНК осаждали с помощью набора реактивов «ДНК-Сорб-В» (Россия) согласно протоколу производителя. Потом центрифугировали при 12000 об/мин, 1 мин и отбирали надосадочную жидкость, представляющую собой раствор ДНК, который можно использовать для полимеразной цепной реакции (ПЦР).
Количественная и качественная оценка препаратов ДНК. Количественную и качественную оценку препаратов ДНК проводили с помощью спектрофотометрического и электрофоретического анализа. Для количественной и качественной оценки растворов ДНК использовали оборудование - Eppendorf BioPhotometer plus (Eppendorf, Германия) или NanoDrop 2000 (Thermo Scientific, США).
Для спектрофотометрического анализа проводили измерение адсорбции водных растворов ДНК при трех длинах волн: 260 нм, 280 нм и 320 нм. Чистоту (наличие примесей РНК и белка) препарата ДНК (D) определяли по коэффициенту: К=D260/D280. Для чистой ДНК К=1,8, для РНК соответствующий показатель — 2,0, для белка — 1,6 и ниже.
Концентрацию ДНК в водном растворе определяли по формуле:
С = (D260 — D320) х 50 х К разведения (мкг/мл),
где D260 — коэффициент поглощения при длине волны 260 нм; D320 — коэффициент поглощения при длине волны 320 нм; Кразведения — коэффициент разведения.
Размер молекул ДНК, также как наличие примесей РНК определяли методом электрофореза в 0,7% агарозном геле (50В, 299 мА, 1 час) после окрашивания бромистым этидием. Визуализация ДНК, РНК проводилась с использованием трансиллюминатора (Pharmacia, Германия) в ультрафиолетовом свете или системы гель-документирования Quantum ST5 (Vilber Lourmat, Германия).
Генотипирование ДНК по STR-маркерам Y-хромосомы. Генотипирование полиморфных 17 STR-локусов (DYS19, DYS389I, DYS389II, DYS390, DYS391, DYS392, DYS393, DYS385a, DYS385b, DYS437, DYS438, DYS439, DYS448, DYS456, DYS458, DYS635, GATA H4) Y-хромосомы, проводили в мультилокусном формате с помощью ПЦР с использованием системы энзиматической амплификации — набора AmpFlSTR YfilerTM (Life Technologies, США).
Полимеразную цепную реакцию проводили в ПЦР-боксе («LS» (Россия)) согласно протоколу изготовителя с использованием амплификатора «Mastercycler» фирмы «Eppendorf» (Германия). Смесь для амплификации объемом 25 мкл включала следующие компоненты: 10 мкл выделенной геномной ДНК (0,5 нг), 0,8 мкл (4 единиц) AmpliTaq Gold ДНК полимераза (Life Technologies, США), 9,2 мкл набора AmpFlSTR YfilerTM ПЦР реакционной смеси, а также 5 мкл набора праймеров AmpFlSTR YfilerTM. Для оценки специфичности реакции амплификации использовали положительный (контрольная ДНК с известными генетическими признаками из набора реагентов) и отрицательный (проба без ДНК) контроли. Стандартные условия ПЦР-амплификации состоял из ферментативной активации в течение 11 мин при 95 °C, затем следовал блок из 30 циклов: денатурация при 94 °C в течение 1 мин, отжиг при 61 °C в течение 1 мин и удлинение при 72 °C в течение 1 мин. Финальное удлинение осуществлялась при 60 °C в течение 80 мин. // Л. Б. Джансугурова, К. Б. Джантаева, Нуржибек, Г. С. Жунусова, Е. Б. Кузовлева, Л. З. Мусралина, Ш. Эвингер, А. Кустар, О. А. Иксан, Э. М. Хусаинова «Выделение и анализ древней ДНК из костных человеческих останков гуннского периода». / Известия национальной Академии Наук Республики Казахстан Института биологии и биотехнологии растений. Серия биологическая и медицинская. 4 (322). Июль—Август, 2017 г. Гл. ред. академик НАН РК, д. м. н., проф. Ж. А. Арзыкулов. Адрес типографии: ИП «Аруна», г. Алматы, ул. Муратбаева, 75. Алматы, НАН РК, 2017. С. 42
Анализ продуктов амплификации. В наборе AmpFlSTR YfilerTM содержится красители, ис- пользуемые для мечения амплифицируемых продуктов: 6-FAM, VIC, NED, PET и LIZ. Продукты амплификации разделяли и определяли на генетическом анализаторе ABI PRISM 310 (Applied Biosystems, США), используя определенный G5 вариабельный биннинговый модуль, как описано в руководстве пользователя. Подготовка образцов и электрофорез на анализаторе ABI PRISM 310 происходил следующим образом: 1 мкл амплифицированного продукта или аллельного лэддера (маркера) и 0,3 мкл 500 LIZ стандартного размера GeneScanTM добавляли к 8,7 мкл деионизован- ному Hi-DiTM формамиду (Applied Biosystems, США), денатурировали при 95°C в течение 3 мин, а затем охлаждали на льду в течение 3 мин. Образцы вводились в течение 10 сек при 5 кВ и под- вергались к электрофорезу при 15 кВ в оптимизированном полимере (POP-4TM полимер) с запус- ком при 60 °C температуре, как указано в GeneScan36vb_POP4DyeSetG5Module. Идентификацию аллелей проводили с помощью программного обеспечения «GeneMapperID» ID-X v1.4 на основе входящих в состав наборов аллельных лэддеров.
Определение гаплотипов Y-хромосомы. Гаплогруппы по У-хромосоме были определены на сайте «Whit Athey's Haplotype Predictor» ([url]http://www.hprg.com[/url]). Процентное соотношение вероят- ности к тем или иным гаплогруппам различается в зависимости от выбора программы (программы по количеству маркеров и гаплогрупп).
Гаплотип определяли с помощью программы «27-Haplogroup Program» для 27 гаплотипов ([url]http://www.hprg.com/hapest5/hapest5b/hapest5.htm[/url]) с учетом максимально известного числа гаплотипов по STR-маркерам.
ПЦР-амплификация гипервариабельных районов митохондриальной ДНК. ПЦР-амплифи- кацию для секвенирования нового поколения (NGS — next generation sequencing) проводили в четырех отдельных реакциях на образец в соответствии с протоколом Human mtDNA D-Loop Hypervariable Region (Illumina, San Diego, CШA) [2] для создания четырех ампликонов, представляющих 2 гипервариабельных района кольцевой митохидриальной ДНК (HVRR1, HVRR2) по следующим позициям нуклеотидов: 29-285, 172-408, 15997-16236 и 16159-16401. Для ПЦР каждый образец палео-ДНК ставили в двух повторностях, в разные дни и разными людьми. Количество и качество ПЦР ампликонов определяли с помощью электрофореза и QuantusTM Fluorometer. ДНК ампликоны нормализовали до 0,2 нг/мкл. и объединяли в соотношении 1: 1: 1: 1 в общей сложности на 20 мкл (5 мкл каждая). Для каждого палео-образца ДНК всего проведено по 10 независимых ПЦР-реакций образцов палео-ДНК, где в качестве источника ДНК использовали разные фрагменты костной ткани (2-3 фрагмента), выделение ДНК и ПЦР реакция проводились разными людьми (5 человек) и в разное время с соблюдением всех санитарно-гигиенических требований для работы с палео-ДНК. Повторение результата не менее 5 раз фиксировали как результат.
Полногеномное секвенирование древней ДНК и биоинформационный анализ результатов секвенирования мтДНК. Из препаратов изолированной палео-ДНК была приготовлена ДНК-биб- лиотека согласно модифицированному протоколу Illumina [2]. Библиотека была секвенирована на платформе Illumina Genome Analyser IIx согласно методике производителя.
Для определения гаплогрупп использовалось программное обеспечение — mtDNA manager [3]. Для анализа полногеномной секвенированной последовательности мтДНК и определения гаплотипов мтДНК также были использованы программы Haplofind ([url]https://haplofind.unibo.it[/url]) и Bioedit ([url]http://www.mbio.ncsu.edu/bioedit/page2.html[/url])..
Результаты исследования и их обсуждение
Для получения препаратов древней ДНК в данной работе мы использовали фрагменты большой берцовой кости посткраниального скелета (инвентарный № 12763) гуннского периода из коллекции Департамента антропологии Венгерского музея естественной истории. Одна из главных проблем при выделении палео-ДНК заключается в опасности загрязнения древнего материала современными образцами ДНК. Для предотвращения возможной контаминации образцов, все манипуляции с костными фрагментами, процедуры выделения и анализа образцов палео-ДНК проводили в стерильных условиях. Этапы предобработки костных фрагментов демонстрирует рисунок 3. // Л. Б. Джансугурова, К. Б. Джантаева, Нуржибек, Г. С. Жунусова, Е. Б. Кузовлева, Л. З. Мусралина, Ш. Эвингер, А. Кустар, О. А. Иксан, Э. М. Хусаинова «Выделение и анализ древней ДНК из костных человеческих останков гуннского периода». / Известия национальной Академии Наук Республики Казахстан Института биологии и биотехнологии растений. Серия биологическая и медицинская. 4 (322). Июль—Август, 2017 г. Гл. ред. академик НАН РК, д. м. н., проф. Ж. А. Арзыкулов. Адрес типографии: ИП «Аруна», г. Алматы, ул. Муратбаева, 75. Алматы, НАН РК, 2017. С. 43
Рисунок 3 — Предобработка древних костных фрагментов перед выделением палео-ДНК:
А-Г — очистка от верхнего слоя; Д — ультразвуковая гомогенизация; Е-Ж — декальцинирование образцов
Древние археологические материалы содержат очень малые количества ДНК, которая обычно сильно фрагментирована. С целью оптимизации процедуры выделения древней ДНК мы использовали различные модификации лизирующего буфера и варьировали время декальцинирования и последующей инкубации в лизирующем буфере, что отразилось на качестве препаратов палео- ДНК. Качественные и количественные характеристики образцов ДНК оценивали с помощью методов спектро- и фотометрического анализов. На рисунке 4 и в таблице 2 представлены качественные и количественные характеристики выделенных образцов палео-ДНК.
Анализ полученных препаратов древней ДНК показал, что все образцы представляют собой высокомолекулярную ДНК, однако наилучшим качеством характеризовались образцы с кодовыми номерами Г-3 и Г-6. Именно они были в дальнейшем использованы для ПЦР-анализа.
Рисунок 4 – Электрофореграмма выделенных образцов палео-ДНК. // Л. Б. Джансугурова, К. Б. Джантаева, Нуржибек, Г. С. Жунусова, Е. Б. Кузовлева, Л. З. Мусралина, Ш. Эвингер, А. Кустар, О. А. Иксан, Э. М. Хусаинова «Выделение и анализ древней ДНК из костных человеческих останков гуннского периода». / Известия национальной Академии Наук Республики Казахстан Института биологии и биотехнологии растений. Серия биологическая и медицинская. 4 (322). Июль—Август, 2017 г. Гл. ред. академик НАН РК, д. м. н., проф. Ж. А. Арзыкулов. Адрес типографии: ИП «Аруна», г. Алматы, ул. Муратбаева, 75. Алматы, НАН РК, 2017. С. 44
Таблица 2 — Характеристики выделенных палео-ДНК
Генотипирование по маркерам Y-хромосомы древних костных останков гуннского периода из Венгрии, определение гаплотипа. Для разрешения вопросов генеалогии, принадлежности к конкретной популяции, генетического разнообразия и эволюционных процессов в современной практике используют микросателлитные STR-локусы, позволяющие почти со 100% достоверностью определять близких родственников [1].
Генотипирование древней ДНК проводили по 17 микросателлитам Y-хромосомы. STR-аллели были определены в нескольких независимых воспроизведениях ПЦР с использованием не менее трех различных экстракций ДНК. Аутентичными считались только аллели, проявившиеся мини- мум в двух повторных анализах. При этих условиях был получен профиль для костных образцов исследуемого скелета. Результаты проведенного анализа представлены на рисунке 5 и в таблице 3.
Рисунок 5 — Результаты генотипирования аппаратно-программным комплексом 310 Genetic Analyzer (Applied Biosystems, США) // Л. Б. Джансугурова, К. Б. Джантаева, Нуржибек, Г. С. Жунусова, Е. Б. Кузовлева, Л. З. Мусралина, Ш. Эвингер, А. Кустар, О. А. Иксан, Э. М. Хусаинова «Выделение и анализ древней ДНК из костных человеческих останков гуннского периода». / Известия национальной Академии Наук Республики Казахстан Института биологии и биотехнологии растений. Серия биологическая и медицинская. 4 (322). Июль—Август, 2017 г. Гл. ред. академик НАН РК, д. м. н., проф. Ж. А. Арзыкулов. Адрес типографии: ИП «Аруна», г. Алматы, ул. Муратбаева, 75. Алматы, НАН РК, 2017. С. 45
Таблица 3 — Анализ STR-гаплотипов Y-хромосомы
Для низкокопийной высокодеградированной ДНК часты выпадающие аллели для STR-маркеров. Как видно из вышеприведенных данных в таблице 3, для исследуемого образца не указаны аллели следующих четырех маркеров: DYS390, DYS391, DYS392, DYS448. Данные аллели формально обозначены нами как неопределенные (ND), поскольку в трех повторяющихся экспериментах с исследуемой ДНК аллели этих маркеров наблюдались только один раз.
Анализ распределения установленных аллелей позволил определить STR-гаплотип Y-хромосомы. Результаты пробного генотипирования показали, что исследуемые костные останки гуннского периода могут характеризоваться 100% по L гаплотипу Y-хромосомы.
Происхождение данной гаплогруппы связывается с Южной Азией, с западом полуострова Индостан. В настоящее время гаплогруппа L присутствует в индийской популяции при общей частоте около 7-15%. Особенно часто встречается среди дравидских высших и средних каст (примерно 17-19%), несколько реже среди племенных групп Индии (примерно 5,6-7%). Но самая высокая частота встречаемости гаплогруппы L и разнообразия ее подклассов отмечается в западной части Пакистана в Белуджистане (28%) [4-8].
Особенно интересным является встречаемость гаплогруппы L у современных казахов. Согласно нашим исследованиям по определению STR-гаплотипов Y-хромосомы у современных казахов (изучено 748 человек казахской национальности), гаплогруппа L с высокой частотой встречается у представителей Среднего жуза, относящихся к роду Аргын. Интересно, что в 2009 году венгерскими учеными было выявлено наличие общих гаплотипов Y-хромосомы в популяции казахских аргын (подрод мадьяр) и венгерских мадьяр, имеющих гуннское происхождение. На основе полученных данных было выдвинуто предположение о вероятной генетической связи казахов с венграми в прошлом [9]. В настоящее время исследования в данном направлении продолжаются в лаборатории популяционной генетики Института общей генетики и цитологии.
Генотипирование мтДНК древних костных останков гуннского периода из Венгрии, определение гаплотипа. Для анализа мтДНК использовали образцы палео-ДНК древнего объекта гуннского периода из Венгрии, экстрагированные из фрагментов костной ткани большой берцовой кости и зуба.
Анализ проводили с использованием секвенирования нового поколения (NGS) на генетичес- ком анализаторе MiSeq (Illumina), в результате удалось прочитать всю последовательность мтДНК и установить следующие мутации и полиморфизмы при сравнении с референсной последователь- ностью: 1.Del(G), 73G, 263G, 311С/T, 489C, 750G, 1438G, 2706G, 3010A, 4769G, 4883T, 5178A, 5973A, 7028T, 7353G, 8273T, 8414T, 87701G, 8860G, 9540C, 10398G, 10400T, 10873C, 11696A, 11719A, 12705T, 14468T, 14766T, 14783C, 15043A, 15300A, 15326G, 15470C, 16223T, 16362C.
С помощью программного обеспечения Haplofind была определена гаплогруппа мтДНК древнего объекта гуннского периода из Венгерского музея естественной истории:
D4j12 гаплотип. Филогения этого гаплотипа (ключевые мутации, определяющие происхождение гаплотипа мтДНК): // Л. Б. Джансугурова, К. Б. Джантаева, Нуржибек, Г. С. Жунусова, Е. Б. Кузовлева, Л. З. Мусралина, Ш. Эвингер, А. Кустар, О. А. Иксан, Э. М. Хусаинова «Выделение и анализ древней ДНК из костных человеческих останков гуннского периода». / Известия национальной Академии Наук Республики Казахстан Института биологии и биотехнологии растений. Серия биологическая и медицинская. 4 (322). Июль—Август, 2017 г. Гл. ред. академик НАН РК, д. м. н., проф. Ж. А. Арзыкулов. Адрес типографии: ИП «Аруна», г. Алматы, ул. Муратбаева, 75. Алматы, НАН РК, 2017. С. 46
Все ключевые мутации, свидетельствующие о филогении D4j12 гаплотипа мтДНК присутствуют в определенном нами гаплотипе.
Филогенетический анализ показывает, что гаплогруппа D возникла в Азии около 60 тыс. лет тому назад. Она является потомком гаплогруппы M. Считается, что гаплогруппа D, также как и С, на территорию северной Азии распространилась в позднеледниковый период из южного Китая через северо-восток Индии [10]. Кроме того, из-за их высокой частоты и широкого распро- странения, гаплогруппы C и D, скорее всего, принимали участие во всех последующих эпизодах предполагаемого потока генов в восточной и северной части Евразии. К ним относятся палео- литическая колонизация Сибири (40-30 тысяч лет назад), дальнейшая реколонизация и возможная замена популяций ранних сибиряков внедрением популяций от побережья озера Байкал, бассейнов рек Енисей и Лена (20 тысяч лет назад), появление неолитической традиции гончарного искусства в лесостепной полосе северной Евразии (начиная примерно 14,5 тысяч лет назад) и ее расширение в Восточно-Европейской равнине (7 тысяч лет назад), неолитическое рассредоточение сельского хозяйства в восточной Азии, расширение Афанасьевской и Андроновской культур (5-3 тысяч лет назад) и более поздних событий, определяющих поток генов в восточной и центральной Евразии [11].
На территории Евразии гаплогруппа D встречается в Северо-Западной Азии, в том числе в Сибири. Также гаплогруппа D довольно часто встречается в Центральной Азии, где она является второй по частоте кладой мтДНК (после H), с низкой частотой гаплогруппа D встречается на северо-востоке Европы и юго-западе Азии [10-12]. Известно, что эта гаплогруппа является одной из 5 мтДНК-гаплогрупп, обнаруженных у коренных народов Америки [13], наряду с такими, как A, B, C и X. Гаплогруппа D мтДНК охватывает почти 20% от общего изменения мтДНК в большинстве северной Азии и сохраняет очень высокую общую частоту среди северных азиатских групп (11-34%), населения Центральной Азии (14-20%) и Восточной Азии (10-43%) [11]. Ее частота снижается на запад и на юг, до 2% или менее, в Индии и Западной Азии, но на Кавказе, Волго-Уральского региона и Юго-Восточной Азии по-прежнему достигает 5-10%. Интересно, что гаплогруппа D встречается также в некоторых северо-восточных европейцев, как карелов, саамов и скандинавов, в то время как гаплогруппа C отсутствует среди них [11].
Aнализ древнего материала показал, что гаплогруппа D мтДНК была обнаружена у мужчины-воина из погребения в Покровске (Якутия), жившего 2400-2200 лет до н.э. [14]. У девочки-подростка из пещеры Хойо Негро (полуостров Юкатан), жившей 13-12 тыс. лет до н.э., была митохондриальная гаплогруппа D1 [15]. Мужчина и женщина хунну из Северо-Восточной Монголии (местность Duurlig Nars), жившие 2000 лет назад, оказались обладателями митохондриальной гаплогруппы D4 [16].
Анализ специфических мутаций гипервариабельных районов мтДНК показал, что возраст главных субкладов D гаплогруппы мтДНК — D4 и D6, очень древний (24-28 тысяч лет назад и 23-42 тысяч лет назад, соответственно) [13]. D4 является наиболее представительной группой и имеет 15 субгрупп, которые по скорости синонимичных мутаций мтДНК можно оценить в пределах 3-42 тысячи лет назад. Практически все субклады D4 встречаются в Восточной Азии, однако распространены и на территории Северной и Южной Азии. Некоторые из этих субкладов имеют очень // Л. Б. Джансугурова, К. Б. Джантаева, Нуржибек, Г. С. Жунусова, Е. Б. Кузовлева, Л. З. Мусралина, Ш. Эвингер, А. Кустар, О. А. Иксан, Э. М. Хусаинова «Выделение и анализ древней ДНК из костных человеческих останков гуннского периода». / Известия национальной Академии Наук Республики Казахстан Института биологии и биотехнологии растений. Серия биологическая и медицинская. 4 (322). Июль—Август, 2017 г. Гл. ред. академик НАН РК, д. м. н., проф. Ж. А. Арзыкулов. Адрес типографии: ИП «Аруна», г. Алматы, ул. Муратбаева, 75. Алматы, НАН РК, 2017. С. 47
характерное географическое распределение, что весьма информативно для анализа геногеографии азиатских народов. Среди современного населения Евразии D4 гаплогруппа мтДНК часто встречается у бурят и хамниган из Бурятии, калмыков из Калмыкии, теленгитов и казахов Алтая. Субклад распространен в Китае, Юго-Восточной Азии, Сибири и Центральной Азии. Также он обнаружен у коренного населения Америки [11].
Согласно данным Деренко с соавторами (2010) по общей скорости мутирования митохондриального генома считается, что D4j гаплогруппа могла возникнуть более 16 тысяч лет назад [11]. По анализу синонимичных мутаций — 17.84 ± 5.11 тысяч лет назад.
Возраст субклада D4j12 оценить пока не представляется возможным, поскольку в известных базах данных и в литературе [11, 17, 18] описано пока только несколько примеров встречаемости этого субклада у современного населения: всего 4, из них 2 относятся к европейским популяциям (женщина из Литвы, 1 скандинав) и 2 к азиатским (1 баргут и 1 бурят из Алтая). Пока неизвестно примеров встречаемости этого субклада у современных казахов.
Тем не менее, наличие этой гаплогруппы у древнего объекта гуннской элиты из Венгрии может свидетельствовать об азиатском происхождении гуннов. В этой связи анализ современных и древних образцов стоит продолжать, поскольку налицо широкий географический разброс (от Восточной Азии до Скандинавии) и редкая встречаемость D4j12 гаплогруппы мтДНК, возможно, свидетельствует о богатстве миграционной истории древних гуннских племен по территории Евразии и низкой репродуктивной активности женских веток древних гуннов.
Легенды гласят, что во время нашествия гуннов в Паннонию, гунны убивали мужчин и насиловали женщин. Таким образом, даже в гуннских ветках современных венгров должен очень слабо читаться «гуннский материнский след».
Как показывают исследования гипервариабельных районов, мтДНК древнего и современного населения Венгрии (27 древних образцов (10-11 веков), 101 современный венгр, и 76 современных образцов обособленной популяции венгров — Sekler из Трансильвании) [19]. Данные были сравнены с 57 популяциями европейских и азиатских народов. Обнаружено, что 2 из 27 древних венгерских образцов однозначно имеют азиатское происхождение, остальные принадлежат к одному из западных гаплогрупп, но имеют некоторое сродство с азиатами. Современное население Венгрии демонстрирует преобладание H, R, T гаплогрупп мтДНК, но по социальному статусу и семейной истории предки этой части населения относились к племенам, обитавшим на территории Венгрии до гуннского нашествия. В то время как гуннские древние образцы и современные потомки имеют гаплогруппы N1a и X, которые обнаруживаются с очень низкой частотой в современных популяциях по всему миру. Как известно, гаплогруппа D4 была обнаружена у древних хунну из Монголии [14]. Свидетельств о встречаемости D4j субклада у древних гуннов с территории Венгрии еще не было.
В целом по ДНК-анализу древнего объекта гуннского периода из Венгерского музея естественной истории можно заключить, что и отцовская линия (Y-хромосомный гаплотип L) и материнская линия (мтДНК гаплотип D4j12) свидетельствуют об азиатском происхождении гуннов. Причем распространенность данных отцовских и материнских линий у современного населения северной Индии, Пакистана и Ирана дает основание предположить возможность миграций древних людей с Передней Азии в Центральную и Восточную Азию через Тибет.
Источник финансирования исследований. Работа была выполнена в рамках научного проекта «Изучение этногенетической истории населения Казахстана», финансируемого АО «Фонд Науки» на 2014–2016 гг. и научного гранта Г.2015 по теме: «Анализ генетической связи между потомками прото-казахской популяции аргын и древними костными останками гуннского периода из Венгрии», финансируемой Государственным учреждением «Комитет науки Министерства образования и науки Республики Казахстан» на 2015–2017 гг.
ЛИТЕРАТУРА
[1] — Кравцова О. А., Нечвалода А. И. Молекулярно-генетический анализ человеческих останков золотоордынского времени из мавзолея Хусейнбека // Уфимский археологический вестник. Вып. 6-7. 2007. С. 195-199.
[2] — Meyer, M. & Kircher, M. Illumina sequencing library preparation for highly multiplexed target capture and sequencing. Cold Spring Harb. Protoc. 2010, doi:10.1101/pdb.prot5448 (2010).[/SIZE] // Л. Б. Джансугурова, К. Б. Джантаева, Нуржибек, Г. С. Жунусова, Е. Б. Кузовлева, Л. З. Мусралина, Ш. Эвингер, А. Кустар, О. А. Иксан, Э. М. Хусаинова «Выделение и анализ древней ДНК из костных человеческих останков гуннского периода». / Известия национальной Академии Наук Республики Казахстан Института биологии и биотехнологии растений. Серия биологическая и медицинская. 4 (322). Июль—Август, 2017 г. Гл. ред. академик НАН РК, д. м. н., проф. Ж. А. Арзыкулов. Адрес типографии: ИП «Аруна», г. Алматы, ул. Муратбаева, 75. Алматы, НАН РК, 2017. С. 48
[3] — Hwan Young Lee, Injee Song, Eunho Ha, Sung-Bae Cho, Woo Ick Yang and Kyoung-Jin Shin. mtDNAmanager: a Webbased tool for the management and quality analysis of mitochondrial DNA control-region sequences // BMC Bioinformatics. 2008. Vol. 9, N. 483. doi: 10.1186/1471-2105-9-483.
[4] — Basu A., Mukherjee N., Roy S., Sengupta S., Banerjee S., Chakraborty M., Dey B., Roy M., Roy B., Bhattacharyya N.P., Roychoudhury S., Majumder P.P. Ethnic India: a genomic view, with special reference to peopling and structure // Genome Res. 2003. No13(10). Р. 2277-2290.
[5] — Cordaux R. et al. Independent Origins of Indian Caste and Tribal Paternal Lineages // Current Biology. 2004. Vol. 14. Р. 231-235.
[6] — Sengupta S. et al. Polarity and Temporality of High-Resolution Y-Chromosome Distributions in India Identify Both Indigenous and Exogenous Expansions and Reveal Minor Genetic Influence of Central Asian Pastoralists // American Journal of Human Genetics. 2006. P. 202-221.
[7] — Thanseem I., Thangaraj K., Chaubey G., Singh V. K., Bhaskar L. V., Reddy B. M., Reddy A. G., Singh L. Genetic affinities among the lower castes and tribal groups of India: inference from Y chromosome and mitochondrial DNA // BMC Genet. 2006. P.7-42.
[8] — Qamar R. et al. Y-Chromosomal DNA Variation in Pakistan // American Journal of Human Genetics. 2002. P. 1107-1124.
[9] — Bíró A.Z., Zalán A., Völgyi A., Pamjav H. A Y-chromosomal comparison of the Madjars (Kazakhstan) and the Magyars (Hungary) // American Journal of Physical Anthropology. 2009. V.139. Is. 3. P. 305-310.
[10] — Kong Q.P., Yao Y.G., Sun C., Bandelt H.J., Zhu C.L., et al. Phylogeny of East Asian mitochondrial DNA liner ages inferred from complete sequences // Am. J. Hum. Genet. 2003. Vol. 73. P. 671–676.
[11] — Derenko M., Malyarchuk B., Grzybowski T., Denisova G., Rogalla U., Perkova M., Dambueva I. and Zakharov I. Origin and Post-Glacial Dispersal of Mitochondrial DNA Haplogroups C and D in Northern Asia // PLoS ONE. 2010. Vol. 5, Is. 12. e15214+
[12] — Volodko N.V., Starikovskaya E.B., Mazunin I.O. et al. Mitochondrial Genome Diversity in Arctic Siberians, with Particular Reference to the Evolutionary History of Beringia and Pleistocenic Peopling of the Americas // The American Journal of Human Genetics. - 2008. Vol. 82. P. 1084–1100. DOI 10.1016/j.ajhg.2008.03.019.
[13] — Comas D., Plaza S., Wells R.S., Yuldaseva N., Lao O., Calafell F., Bertranpetit J. Admixture, migrations, and dispersals in Central Asia: evidence from maternal DNA lineages // European Journal of Human Genetics. - 2004. Vol. 12, N. 6. P. 495-504.
[14] — Amory S., Crubézy E., Keyser C., Alekseev A.N., Ludes B. Early influence of the steppe tribes in the peopling of Siberia // Human Biology. 2006. Vol. 78, N. 5. P. 531–549.
[15] — James C. Chatters, Douglas J. Kennett, Yemane Asmerom, Brian M. Kemp, Victor Polyak, Alberto Nava Blank, Patricia A. Beddows, Eduard Reinhardt, Joaquin Arroyo-Cabrales, Deborah A. Bolnick, Ripan S. Malhi, Brendan J. Culleton, Pilar Luna Erreguerena, Dominique Rissolo, Shanti Morell-Hart, Thomas W. Stafford Jr. Late Pleistocene Human Skeleton and mtDNA Link Paleoamericans and Modern Native Americans // Science. 2014. Vol. 344, Is. 6185. P. 750-754. DOI: 10.1126/science.1252619
[16] — Behar D.M., van Oven M., Rosset S., Metspalu M., Loogväli E.L., Silva N.M., Kivisild T., Torroni A. and Villems R. A “Copernican” reassessment of the human mitochondrial DNA tree from its root. // American J. Human Genetics. 2012. Vol. 90, N. 4. P. 675-684.
[17] — Zheng, H. X., Yan, S., Qin, Z. D., & Jin, L. MtDNA analysis of global populations support that major population expansions began before Neolithic Time // Nature Scientific Reports. – 2012. Vol. 2. doi:10.1038/srep00745
[18] — Pankratov V, Litvinov S, Kassian A, et al. East Eurasian ancestry in the middle of Europe: genetic footprints of Steppe nomads in the genomes of Belarusian Lipka Tatars // Scientific Reports. 2016. – Vol. 6:30197. doi:10.1038/srep30197.
[19] — Tömöry G., Csányi B., Bogácsi-Szabó E., Kalmár T., Czibula A., Csosz A., Priskin K., Mende B., Langó P., Downes C.S., Raskó I. Comparison of maternal lineage and biogeographic analyses of ancient and modern Hungarian populations // American Journal of Physical Anthropology. 2007. Vol.134, Is. 3. P. 354-368. // Л. Б. Джансугурова, К. Б. Джантаева, Нуржибек, Г. С. Жунусова, Е. Б. Кузовлева, Л. З. Мусралина, Ш. Эвингер, А. Кустар, О. А. Иксан, Э. М. Хусаинова «Выделение и анализ древней ДНК из костных человеческих останков гуннского периода». / Известия национальной Академии Наук Республики Казахстан Института биологии и биотехнологии растений. Серия биологическая и медицинская. 4 (322). Июль—Август, 2017 г. Гл. ред. академик НАН РК, д. м. н., проф. Ж. А. Арзыкулов. Адрес типографии: ИП «Аруна», г. Алматы, ул. Муратбаева, 75. Алматы, НАН РК, 2017. С. 49
http://nauka-nanrk.kz/ru/assets/журнал%202017%204/Биология_04_2017__Готов.pdf









Комментарии
Отправить комментарий